Jama ustna jako złożone środowisko, zasiedlana jest przez ponad 700 gatunków bakterii, wirusów i grzybów. Nosicielami S. aureus jest ok. 24-30% zdrowych osób. Duży problem kliniczny stanowią szczepy MRSA i VRSA, które w sprzyjających warunkach, związanych z obniżeniem odporności nosiciela mogą wywoływać trudne w leczeniu zakażenia. Jednym ze sposobów, wspomagających codzienną higienę jamy ustnej jest stosowanie płukanek jamy ustnej.
Jama ustna jako środowisko życia bakterii wirusów i grzybów jest bardzo złożonym ekosystemem. Szacuje się, że środowisko jamy ustnej zasiedla ponad 700 gatunków bakterii, wirusów i grzybów.1 Bakterie te w warunkach fizjologicznych zasiedlają błonę śluzową, powierzchnię zębów, kieszeni dziąsłowych języka i gardła.
U osób użytkujących uzupełnienia protetyczne klasyczne oraz wsparte na implantach, czy też u osób leczonych ortodontycznie zmienia się proporcjonalny i jakościowy stosunek bakterii, zasiedlających jamę ustną.2-4 W warunkach fizjologicznych bakterie koegzystujące pozostają w równowadze i nie wywołują chorób.
Środowisko jamy ustnej, ze względu na swoją charakterystykę pozwala na wyróżnienie wielu form egzystencji drobnoustrojów. W jamie ustnej wyróżniamy bakterie w formie planktonicznej oraz tworzące biofilm. Biofilm tworzony jest przez formy planktoniczne, które po wstępnym etapie adhezji do komórek i innych struktur gospodarza rozpoczynają kolonizację zasiedlonej powierzchni. Kolejne warstwy komórek bakterii tworzą warstwy otoczone macierzą, zbudowaną z polimerów cukrów i białek, przytwierdzonych do powierzchni biotycznych i abiotycznych. Płytka i kamień nazębny są wielogatunkowym biofilmem, tworzonym wg określonej kolejności przez bakterie głównie z rodzaju Streptococcus Actinomyces i Corynobacterium.4-6 Poprzez wytworzenie przez bakterie trójwymiarowej, zorganizowanej struktury, środki bakteriobójcze i bakteriostatyczne posiadają ograniczoną zdolność do penetracji w głąb biofilmu. Jedynym skutecznym sposobem usunięcia biofilmu jest jego mechaniczne rozbicie, oderwanie od struktur podtrzymujących i usunięcie jego struktury poza jamę ustną. Do urządzeń mechaniczne usuwających biofilm zaliczmy szczotki dentystyczne, kirety oraz różnego rodzaju skalery ultradźwiękowe, a także inne urządzenia powszechnie stosowane w zabiegach higienizacji.7 Narastanie płytki nazębnej powoduje zwiększenie odpowiedzi immunologicznej organizmu, którego kliniczną manifestacją jest stan zapalny dziąsła oraz przyzębia, dlatego konieczne jest systematyczne przeprowadzanie zabiegów higienizacji osobistej oraz profesjonalnej.8
U części populacji, wśród bakterii kolonizujących jamę ustna i nosogardło, znajdują się bakterie z rodzaju Staphylococus aureus (bakteria gram-dodatnia, powszechnie występującą). Bakteria ta jest jednym z niebezpieczniejszych patogenów ludzkich. Szczególnie niebezpieczne są szczepy MRSA (Methicilin-resistant S. Aureus), oporne na leczenie antybiotykami betalaktamowymi.9,10 S. aureus jest jedną z głównych przyczyn zakażeń u pacjentów z obniżona odpornością, zwłaszcza pacjentów po zabiegach chirurgicznych.11 Udowodniono, że bakterie z rodzaju S. aureus są odpowiedzialne za zakażenia okołowszczepowe implantów dentystycznych, wywołując zjawisko periimplantitis.4,12
Wśród nosicieli S. aureus zaobserwować możemy zmienność występowania, uzależnioną od wieku, regionu polityki antybiotykowej oraz wykonywanego zawodu. Grupą zawodową szczególnie narażoną na nosicielstwo S. aureus są pracownicy ochrony zdrowia.13 Wśród lekarzy, lekarzy dentystów, pielęgniarek oraz personelu pomocniczego stwierdzono większy odsetek nosicieli S. aureus, zwłaszcza opornych na antybiotyki MRSA. Bakterie z grupy S. aureus wykazują dużą zdolność do wytwarzania oporności lekowej. Doniesienia ostatnich lat wskazują na pojawianie się szczepów opornych na inne grupy antybiotyków, w tym opornych na wankomycynę (VRSA).14 Leczenie pacjentów z zakażeniem MRSA lub WRSA jest trudne i często nieskuteczne.
Do rutynowych zabiegów higienizacji domowej zaliczyć można szczotkowanie zębów z zastosowaniem różnego rodzaju past do zębów. Mniej popularnym, ale również istotnym sposobem higienizacji jest stosowanie płukanek dentystycznych jako uzupełniających w codziennych zabiegach higienizacyjnych.
Płukanki stomatologiczne stosowane jako wspomagające w utrzymaniu higieny jamy ustnej zawierają najczęściej enzymy, olejki eteryczne, wyciągi roślinne, pochodne fenolu, jodofory, związki uwalniające tlen, pochodne chlorheksydyny, 4-rzędowe zasady amoniowe, oraz mieszanki tych substancji. Chlorheksydyna jest jedną z substancji powszechnie stosowaną w stomatologii, wykazującą silne działanie bakteriobójcze i bakteriostatyczne. Wielu producentów stosuje ją jako jedną z substancji aktywnych, najczęściej w stężeniu od 0,1% do 0,2%. Popularną formą jest diglikuronian chlorheksydyny. Liczba płukanek posiadających w swojej zawartości chlorheksydynę jest znaczna i są one powszechnie dostępne.15,16
Badania in vitro wykazały działanie bakteriobójcze i bakteriostatyczne chlorheksydyny, zwłaszcza na bakterie gram-dodatnie. Celem niniejszej pracy jest ocena in vivo wpływu preparatów uzupełniających higienę jamy ustnej zawierających chlorheksydynę na występowanie S. aureus w jamie ustnej.
Materiały i metody
W badaniu uczestniczyło 60 zdrowych, pełnoletnich pacjentów w wieku 30-60 lat, standardowo zgłaszających się na badanie dentystyczne, spełniających kryteria włączenia. Grupę badaną stanowiło 30 pacjentów, którzy jako uzupełnienie zabiegów higienicznych jamy ustnej stosowali płukanki stomatologiczne ze stężeniem chlorheksydyny 0,2-0,05%, zgodnie z zaleceniami producenta. Jednym z kryteriów włączenia do badania było stosowanie płukanki w czasie badania. Pacjenci, którzy stosowali płukanki, ale byli w trakcie przerwy wynikającej w zaleceń producenta, nie byli włączani do badania. Grupę kontrolną stanowiło 30 pacjentów, niestosujących w higienie jamy ustnej żadnych płukanek.
Badanie podzielono na 2 etapy: etap kliniczny oraz laboratoryjny. Wszystkie osoby włączone do badania nie miały w swojej historii hospitalizacji i przynajmniej od 6 miesięcy nie stosowały antybiotykoterapii.
Etap kliniczny składał się z badania podmiotowego, w skład którego wchodziła ankieta określająca stan zdrowia oraz nawyki higieniczne. Badanie przedmiotowe obejmowało badanie dentystyczne z uwzględnieniem aproksymalnego wskaźnika płytki nazębnej API oraz badania krwawienia kieszonek przy zgłębnikowaniu (BI). Otrzymane wyniki zostały przeliczone i poddane ocenie. Następnie pacjent, wyrażając świadomą zgodę, przekazał 20 ml śliny w celu przeprowadzenia badań laboratoryjnych.
Etap laboratoryjny polegał na izolacji genomowego DNA ze śliny pacjentów przy użyciu komercyjnego zestawu do izolacji DNA genomic Mini (A&A Biotechnology), zgodnie z zaleceniami producenta. Ocena czystości i jakości wyizolowanego DNA opierała się na elektroforezie agarozowej. Wyizolowane DNA poddawano amplifikacji i detekcji przy użyciu gatunkowo specyficznej reakcji wykrywającej; gen 16s rRna (Ryc. 1) specyficzny dla gatunku S. aureus i gen mecA (Ryc. 2) specyficzny dla szczepów metycylinoopornych, przy użyciu starterów opisanych przez McClure.17 Otrzymane wyniki kliniczne i laboratoryjne zestawiono i poddano analizie.
Wyniki
Badanie ankietowe pozwoliło na uzyskanie informacji dotyczących nawyków higienicznych. 68% badanych w obu grupach deklarowało czyszczenie zębów co najmniej 2 razy dziennie. Ponad połowa badanych (58%) podawała średni czas szczotkowania zębów jako 2 min. 60% badanych podało, że zgłasza się przynajmniej raz w roku na rutynową kontrolę stomatologiczną.
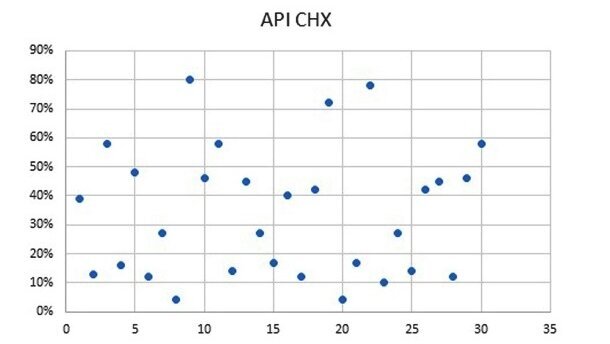
U osób z grupy stosującej płukanki zaobserwowano niższy średni wskaźnik płytki w Badaniu API. Wynosił on odpowiednio 34% i 41% (Ryc. 3-5) u osób niestosujących płukanek. Nie zaobserwowano znaczącej różnicy pomiędzy wskaźnikami krwawienia w obu grupach, które średnio wynosiły 12% w grupie używającej płukanki i 14% w grupie osób niestosującej płukanek (Ryc. 6 i 7).
W grupie stosującej płukanki stwierdzono 30% osób będących nosicielami S. aureus w stosunku do prawie 50% (Ryc. 8) u osób wyłącznie szczotkujących zęby. Stosunek szczepów MRSA u pacjentów będących nosicielami S. aureus i stosujących płukanki był 3-krotnie niższy i wynosił 20%, niż u pacjentów niestosujących płukanek, u których udział szczepów MRSA wynosił prawie 60% (Ryc. 9).
Dyskusja
Zdrowie całego organizmu uzależnione jest od kruchej równowagi pomiędzy stanem odporności a naturalną florą bakteryjną, zasiedlającą organizm. Jama ustna jest ekosystemem, w którym koegzystują bakterie tlenowe beztlenowe gram-dodatnie i gram-ujemne. Liczną grupą bakterii w jamie ustnej są bakterie oportunistyczne, które w warunkach pełnego zdrowia występują jako flora i nie stanowią zagrożenia dla nosiciela, jednak w warunkach sprzyjających, takich jak osłabienie organizmu wywołane chorobą lub zabiegiem chirurgicznym wywołują inwazję na nosiciela. Jednym z takich gatunków bakterii jest S. aureus, który występuje jako flora przejściowa u licznej części populacji, jednak w sprzyjającym środowisku może wywoływać trudne do leczenia jednostki chorobowe. Pojawienie się szczepów MRSA w znacznym stopniu ogranicza konwencjonalne leczenie zakażeń. Przeprowadzone badania in vivo pokazały, że u pacjentów stosujących płukanki dentystyczne występuje mniejsza liczba nosicieli S. aureus oraz mniejszy odsetek szczepów MRSA. Otrzymane wyniki mogą być przesłanką do stosowania płukanek stomatologicznych zawierających chlorheksydynę u pacjentów z niekompetencją immunologiczną, u osób przed i po zabiegach chirurgicznych oraz posiadających tytanowe wszczepy śródkostne.
embedImagecenter("Imagecenter_1_2489",2489, "large");
Autorzy:
Bartłomiej Iwańczyk, Igor Kresa, Karolina Szaniawska, Andrzej Wojtowicz – Zakład Chirurgii Stomatologicznej, Warszawski Uniwersytet Medyczny.
Izabela Strużycka – Zakład Stomatologii Zintegrowanej, Warszawski Uniwersytet Medyczny.
Kamila Strom, Anna Minkiewicz, Gabriela Oledzka – Zakład Biologii Medycznej, Warszawski Uniwersytet Medyczny.
Uwaga redakcyjna:
Piśmiennictwo
1. Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH et al. The human oral microbiome. J Bacteriol 2010; 192: pp. 5002-5017.
2. Ahn, Sug-Joon, Bum-Soon Lim, Shin-Jae Lee. Surface characteristics of orthodontic adhesives and effects on Streptococcal adhesion. American Journal of Orthodontics and Dentofacial Orthopedics: Official Publication of the American Association of Orthodontists, Its Constituent Societies and the American Board of Orthodontics 137, no. 4 (2010): 489-95.
3. Salvi G, Fürst M, Lang N and Persson G. One-year bacterial colonization patterns of Staphylococcus Aureus and other bacteria at implants and adjacent teeth. 19, no. 3 (2008): 242-48.
4. Subramani, Karthikeyan, Ronald E, Jung, Aart Molenberg, Christoph HF Hammerle, Haemmerle K. Biofilm on dental implants: A review of the literature. International Journal Of Oral & Maxillofacial Implants 24, no. 4 (2009): 616-26.
5. Walczewska M, Marcinkiewicz J, Pasich E, Pasich A. Mechanizm i czynniki ryzyka powstawania biofilmu bakteryjnego jamy ustnej. Postępy Higieny i Medycyny Doswiadczalnej 67 (2013): 736-41.
6. Löe H, Else T, Borglum SJ and Rindom SchiØtt C. Experimental gingivitis in man. Journal of Periodontal Research 2, no. 4 (1967): 282-89.
7. Thurnheer T, Rohrer E, Belibasakis GN, Attin T and Schmidlin PR. Static biofilm removal around ultrasonic tips in vitro. Clinical Oral Investigations 18, no. 7 (2014): 1779.
8. Figueiredo MC and Arruda F. Evaluation of the efficiency the association of interspace and a conventional toothbrush with a conventional toothbrush on the control of biofilm dental plaque on occlusal surfaces of deciduous molars in eruption period. Journal of Dental Research 80, no. 4 (2001): 959.
9. Haaber J, Thorup Cohn M, Dorte F, Joest Andersen T, Ingmer H and Otto M. Planktonic aggregates of Staphylococcus Aureus protect against common antibiotics (Properties of S. Aureus aggregates). PLoS ONE 7, no. 7 (2012): E41075.
10. Paterson GK, Morgan FJE, Harrison EM, Cartwright EJP, Török ME, Zadoks RN, Parkhill J, Peacock SJ Holmes MA. Prevalence and characterization of human MecC Methicillin-resistant Staphylococcus Aureus isolates in England. The Journal of Antimicrobial Chemotherapy 69, no. 4 (2014): 907-10.
11. Kluytmans JAJW et al. Nasal carriage of Staphylococcus aureus as a major risk factor for wound infections after cardiac surgery. Journal of Infectious Diseases 171.1 (1995): 216-219.
12. Mombelli A, Decaillet F. The characteristics of biofilms in peri-implant disease. Journal Of Clinical Periodontology 38 (2011): 203-13.
13. Cespedes C et al. Differences between Staphylococcus aureus isolates from medical and nonmedical hospital personnel. Journal of clinical microbiology 40.7 (2002): 2594-2597.
14. Staphylococcus Aureus VRSA-11B is a constitutive vancomycin-resistant mutant of vancomycin-dependent VRSA-11A. Antimicrobial Agents and Chemotherapy 56, no. 9 (2012): 4693.
15. Herrera D. Chlorhexidine mouthwash reduces plaque and gingivitis. Evidence-Based Dentistry 14, no. 1 (2013): 17.
16. Gjermo P. Chlorhexidine in Dental Practice. Journal of Clinical Periodontology 1, no. 3 (1974): 143-52.
17. McClure JA, Conly J, Lau M, Elsayed V, Sameer L, Hutchins TW and Zhang K. Novel multiplex PCR assay for detection of the Staphylococcal Virulence marker Panton-Valentine Leukocidin Genes and simultaneous discrimination of Methicillin-Susceptible from –resistant Staphylococci. Journal of Clinical Microbiology 44, no. 3 (2006): 1141.
LIPSK, Niemcy: Sztuczna inteligencja (AI), jest w coraz większym stopniu obecna w wielu przestrzeniach życia, również w stomatologii, oferując ...
Znaczenie dobrego zdrowia jamy ustnej od najmłodszych lat jest przesłaniem, które wciąż musi być ponawiane, aby dotrzeć do wielu osób. Niedawno ...
Wybielanie zębów jest jednym z najbardziej powszechnych zabiegów stomatologii estetycznej. American Academy of Cosmetic Dentistry ...
Dobre zdrowie jamy ustnej jest coraz częściej uznawane za niezbędny element zdrowego starzenia się. Jest to ściśle związane z ogólnym stanem zdrowia...
Opublikowano wiele badań dotyczących związku między próchnicą a różnymi czynnikami kontekstowymi rodziny, jednak podobne badania dotyczące chorób ...
Zawartość lodówki i koszyka w sklepie może mieć znaczący wpływ na zdrowie jamy ustnej – przekonują dentyści. Im więcej słodyczy, tym ...
Dyskusja na temat związku między zapaleniem przyzębia a nadciśnieniem nie jest nowa. Uznając to oraz fakt, że wciąż nie ma wystarczających ...
Cigna – ogólnoświatowa organizacja usług zdrowotnych opublikowała badanie, które potwierdza związek między zdrowiem jamy ustnej a pewnością ...
Eksperci apelują do rodziców, wzywając ich do zaprzestania karmienia dzieci butelką z powodu wzrastającej liczby przypadków ostrej ...
Eksperci apelują do rodziców, wzywając ich do zaprzestania karmienia dzieci butelką z powodu wzrastającej liczby przypadków ostrej ...
Webinarium na żywo
wto. 24 lutego 2026
7:00 (CET) Warsaw
Prof. Dr. Markus B. Hürzeler
Webinarium na żywo
wto. 24 lutego 2026
9:00 (CET) Warsaw
Prof. Dr. Marcel A. Wainwright DDS, PhD
Webinarium na żywo
śro. 25 lutego 2026
5:00 (CET) Warsaw
Prof. Dr. Daniel Edelhoff
Webinarium na żywo
śro. 25 lutego 2026
7:00 (CET) Warsaw
Webinarium na żywo
czw. 26 lutego 2026
2:00 (CET) Warsaw
Webinarium na żywo
wto. 3 marca 2026
5:00 (CET) Warsaw
Dr. Omar Lugo Cirujano Maxilofacial
Webinarium na żywo
śro. 4 marca 2026
2:00 (CET) Warsaw
Dr. Vasiliki Maseli DDS, MS, EdM



 Austria / Österreich
Austria / Österreich
 Bośnia i Hercegowina / Босна и Херцеговина
Bośnia i Hercegowina / Босна и Херцеговина
 Bułgaria / България
Bułgaria / България
 Chorwacja / Hrvatska
Chorwacja / Hrvatska
 Czechy i Słowacja / Česká republika & Slovensko
Czechy i Słowacja / Česká republika & Slovensko
 Francja / France
Francja / France
 Niemcy / Deutschland
Niemcy / Deutschland
 Grecja / ΕΛΛΑΔΑ
Grecja / ΕΛΛΑΔΑ
 Węgry / Hungary
Węgry / Hungary
 Włochy / Italia
Włochy / Italia
 Holandia / Nederland
Holandia / Nederland
 nordycki / Nordic
nordycki / Nordic
 Polska / Polska
Polska / Polska
 Portugalia / Portugal
Portugalia / Portugal
 Rumunia i Mołdawia / România & Moldova
Rumunia i Mołdawia / România & Moldova
 Słowenia / Slovenija
Słowenia / Slovenija
 Serbia i Czarnogóra / Србија и Црна Гора
Serbia i Czarnogóra / Србија и Црна Гора
 Hiszpania / España
Hiszpania / España
 Szwajcaria / Schweiz
Szwajcaria / Schweiz
 indyk / Türkiye
indyk / Türkiye
 Wielka Brytania i Irlandia / UK & Ireland
Wielka Brytania i Irlandia / UK & Ireland
 Międzynarodowy / International
Międzynarodowy / International
 Brazylia / Brasil
Brazylia / Brasil
 Kanada / Canada
Kanada / Canada
 Ameryka Łacińska / Latinoamérica
Ameryka Łacińska / Latinoamérica
 USA / USA
USA / USA
 Chiny / 中国
Chiny / 中国
 Indie / भारत गणराज्य
Indie / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Wietnam / Việt Nam
Wietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Izrael / מְדִינַת יִשְׂרָאֵל
Izrael / מְדִינַת יִשְׂרָאֵל
 Algieria, Maroko i Tunezja / الجزائر والمغرب وتونس
Algieria, Maroko i Tunezja / الجزائر والمغرب وتونس
 Bliski Wschód / Middle East
Bliski Wschód / Middle East















































To post a reply please login or register